Rouille jaune
Nom scientifique
Puccinia striiformis Westend
Cette espèce comprend 9 sous espèces déterminées suivant leur hôte appartenant au genre des céréales. Ainsi, la rouille jaune du blé est causée par la sous espèce Puccinia striiformis f. sp. tritici Erikss.
La rouille jaune est causée par Puccinia striiformis, un champignon basidiomycète[1] biotrophe[2]. Cette maladie courante en Belgique est également très répandue à travers le globe. Ses spores peuvent être emportées par le vent sur de longues distances. Les hôtes principaux de ce pathogène sont le blé, le triticale et l’épeautre. Jusqu’à 70% de perte de rendement peuvent être observés en cas d’infection grave sur variété sensible.
Symptômes
En Belgique, les premiers symptômes de rouille jaune sont le plus souvent observés entre mars et avril, mais quelquefois dès le mois de février, si les conditions sont favorables. La maladie est capable d’évoluer dans les cultures tant que les températures ne sont pas trop chaudes (>25°C). C’est pourquoi, à partir de juin, ne subsistent souvent que des nécroses.
Au niveau du champ :
Les premières pustules sont visibles sur les feuilles basses de quelques plantes. Rapidement, des foyers circulaires jaunes, nettement délimités, et inférieurs à 1m² se distinguent du reste du champ. Lorsque les conditions sont favorables, l’infection peut rapidement se propager à toute la parcelle.
Sur feuille
Au niveau de la face supérieure des feuilles de céréales infectées, la reproduction asexuée du champignon se manifeste par la formation de petites pustules de rouille ovales jaune-orange. Celles-ci mesurent entre 0.3 et 1 mm de long et sont remplies de spores (masse poudreuse).
Sur les jeunes plantules, les pustules se trouvent dispersées sur toute la largeur de la feuille contaminée. Plus tard, à partir de l’élongation de la tige, les pustules sont alignées entre les nervures et forment ainsi des stries parallèles, typiques de cette maladie.
En fin d’épidémie, lorsque la plante hôte a atteint le stade de développement des graines (stade 71 BBCH et au-delà) et que les températures augmentent, Puccinia striiformis se met à produire des pustules noires allongées. Celles-ci contiennent des spores du nom de téleutospores. Ces dernières sont incapables d’infecter les céréales mais bien l’épine-vinette (Berberis spp.).
Sur épis
Exceptionnellement, la rouille jaune peut atteindre les épis au moment de la floraison. Les pustules se logent entre la glume et les glumelles et entre le grain et les glumelles. Cette maladie n’est cependant pas transmise par les semences. L’impact sur le rendement d’une infection des épis est mal connu.
La détecter
Lorsqu’en fin d’hiver ou au printemps, des ronds jaunes apparaissent dans un champ, il faut immédiatement en identifier l’origine, parce que l’évolution peut être très rapide.
Distinguer rouille jaune et rouille brune
La rouille jaune se répartit d’abord en foyers. Les feuilles contaminées présentent des pustules jaune-orange alignées sous forme de stries.
La rouille brune, quant à elle, se répartit de façon homogène dans le champ contaminé. Les feuilles infectées présentent des pustules orange-brune, plus grosses que celles de la rouille jaune, réparties aléatoirement sur la surface foliaire.
Epidémiologie
La rouille jaune est un champignon hétéroïque[3], dont le cycle de vie complexe implique jusqu’à cinq sortes de spores différentes. La reproduction asexuée de Puccinia striiformis se déroule sur son hôte primaire : les céréales (principalement le blé, l’épeautre, le triticale) ou certaines graminées sauvages. La reproduction sexuée se déroule, quant à elle, sur son hôte secondaire : l’épine-vinette (Berberis spp.)[4].
Distribution géographique :
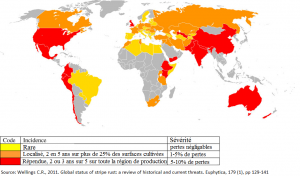
La rouille jaune est répandue dans de nombreux pays à travers le monde grâce à sa capacité de migrer sur de longues distances via ses spores.
Cette maladie est observée dans toute la Belgique mais les régions côtières sont touchées plus fréquemment et plus intensément que l’intérieur du pays.
Figure 4 : répartition de la rouille jaune, Puccinia striiformis, dans les pays producteurs de blé sur la période de 2000 à 2009. Source : Wellings C.R., 2011. Global status of stripe rust : a review of historical and current threats. Euphytica, 179 (1), pp 129-141.
Cycle de vie :
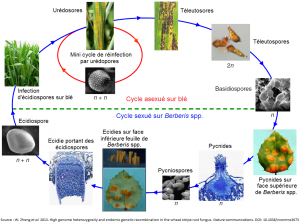
Reproduction asexuée :
A la toute fin de l’hiver, des urédosores (pustules) de rouille jaune sont observables sur les feuilles basses des céréales infectées. Ces premières infections initient l’épidémie sur l’hôte primaire. Les urédospores seront produites par voie asexuée aussi longtemps que les conditions météorologiques le permettront. Des symptômes de chlorose sont observables 6 à 8 jours après l’infection d’une feuille par une spore ; l’apparition de pustules et de nouvelles spores survient 12 à 14 jours après l’infection sous conditions favorables. Le champignon est capable de passer l’hiver sous forme de mycélium au sein des feuilles de la plante hôte. Si ces feuilles survivent à l’hiver, le champignon survivra également.
Reproduction sexuée :
Le déclenchement de la sénescence des tissus infectés de la céréale hôte et la hausse des températures induisent la production de pustules noires par Puccinia striiformis. Ces dernières structures, plus allongées que les urédosores, sont appelées « téleutosores ». Chaque pustule contient des spores, appelées téleutospores. Ces dernières n’ont pas ou peu de dormance et vont germer rapidement et produire des basidiospores de « mating-type[5] » + et –. Ces dernières sont capables d’infecter l’hôte alternatif, Berberis spp. ou épine-vinette. Une fois sur l’hôte alternatif, les basidiospores germent et forment des pycnides sur la face supérieure des feuilles. Suivant le « mating-type » de la basidiospore d’origine, les pycnides produisent des pycniospores et des hyphes de « mating-type » + ou -. Une recombinaison a alors lieu lorsque les pycniospores et les hypes de « mating-type » opposés fusionnent. Les pycnides fécondées vont produire des « écidies » sur la face inférieure des feuilles de Berberis spp. Ces structures en forme de coupe contiennent des centaines d’écidiospores. Ces dernières sont capables d’infecter l’hôte primaire et d’ainsi recommencer un cycle asexué, par la production d’urédosores.
Le cycle sexué de Puccinia striiformis n’a cependant encore jamais été observé en Europe. Pour boucler ce cycle, une synchronisation est nécessaire entre la prévalence, la susceptibilité et la phénologie de l’hôte alternatif, l’épine-vinette, et celle de l’hôte primaire, la céréale ou la graminée sauvage. Ce qui ne semble pas être le cas en Europe. De plus, le fait que les téleutospores germent rapidement pour produire des basidiospores (qui s’épuisent très vite) signifierait que l’épine-vinette ne joue qu’un rôle mineur dans la survie du pathogène.
Figure 5 : cycles de reproduction sexuée et asexuée de Puccinia striiformis. Source : W. Zheng et al. 2013. High genome heterozygosity and endemic genetic recombination in the stripe rust fungus. Nature communications. DOI: 10.1038/ncomms3673.
Races de rouille jaune
Puccinia striiformis sp. tritici, est subdivisée en races. Celles-ci sont déterminées par leur contournement des différents gènes de résistances présents dans les variétés de blé cultivées. Les races évoluent au fil des années grâce à leur reproduction sexuée qui leur permet des recombinaisons de gènes et donc de s’adapter aux gènes de résistances des cultivars de blé.
Ces races sont également caractérisées par des niveaux de virulence différents : plus une race est capable de contourner de gènes de résistance chez ses hôtes, plus celle-ci sera considérée comme virulente. La race Warrior en est un bel exemple. En effet, cette dernière est apparue dans le nord-ouest de l’Europe en 2011 en supplantant toutes les anciennes races comme Oakley, Toisondor, Robigus et Ornicar. En 2012 et 2013, sa fréquence avait atteint plus de 90% faisant d’elle la race dominante. Au cours des années 2015-2016, les chercheurs se sont rendu compte que Warrior n’était pas une race unique mais bien un groupe de races ayant des profils de virulence sensiblement différents.
Pour plus de renseignement sur la répartition des races de rouille jaune en Europe, veuillez consulter le site internet Eurowheat[6] (site en anglais).
Situations à risque
Risque au niveau du champ :
Le choix de la variété est un élément primordial lors de l’installation de la culture. Plus cette variété est sensible à la rouille jaune et plus les pertes pourraient s’avérer importantes en cas d’épidémie. Il est donc très important de se renseigner sur les sensibilités des variétés aux maladies. Malheureusement, le contournement de la résistance d’une variété par une nouvelle race de rouille jaune n’est pas prévisible lors des semis. L’arrivée d’une nouvelle race de Puccinia striiformis peut donc rendre soudainement sensible une variété en cours de saison. Si un tel cas de figure se présente, l’information sera rapidement diffusée via le CADCO.
Comme la plupart des maladies en céréales, la rouille jaune est favorisée par l’humidité. Il est donc important de n’exagérer ni la densité de semis, ni la fumure azotée.
Les repousses permettent au pathogène de survivre durant la période estivale. Leur destruction permet donc de réduire la pression de la maladie pour la saison suivante.
Risques liés au climat :
La rouille jaune se développe tout particulièrement bien durant les printemps frais et humides, avec des moyennes modérées entre 9 et 15°C. Le démarrage d’un cycle de rouille jaune (= germination des spores et infection) peut être identifié sur base de la formation de rosée dans les champs et des températures nocturnes. En effet, il faut au moins 3h d’humidité saturée (rosée) aux urédospores pour germer et infecter les tissus. C’est en fin de nuit que les températures sont basses et que la rosée est présente, réunissant ainsi les conditions propices à l’infection par la rouille jaune. Au-delà de 15°C, le pathogène ralentit peu à peu son développement.
Durant l’hiver, la température est également le facteur majeur qui influence la survie de la rouille jaune. Les urédospores peuvent survivre à des températures allant jusque -4°C, au-delà, l’inoculum se trouve diminué en début de saison. Les températures inférieures à -10°C peuvent interrompre le développement du pathogène survivant dans les feuilles infectées (mycélium) sans pour autant le tuer.
Enfin, le vent joue un rôle majeur dans la dispersion de la maladie dans la culture mais également dans les champs avoisinants. Le timing, le type et la direction des vents déterminent la précocité, et l’échelle de l’épidémie de rouille jaune.
Méthodes de lutte
Leviers agronomiques
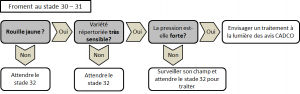
Le moyen de lutte le plus économique et le plus efficace est de choisir une variété résistante à la rouille jaune. La plupart des mécanismes de résistance des variétés s’enclenchent après le stade montaison (30 BBCH). Des symptômes de la maladie sont donc observables sur les variétés résistantes jusqu’à ce stade. La progression de la maladie s’arrêtera d’elle-même lors de la croissance de la culture. Il est donc important de bien se renseigner sur la variété avant de programmer un traitement qui n’est parfois pas nécessaire.
Lutte chimique
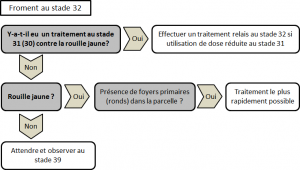
Un traitement systématique n’est pas recommandé mais il est conseillé de surveiller les cultures dès la sortie de l’hiver.
Pour les variétés très sensibles (cote de 5 et moins), un traitement au stade épi 1 cm (31 BBCH) peut déjà être nécessaire en cas de très forte infection (pustules sporulantes observables sur quasiment 100% des plantes). Pour conserver l’efficacité de cette protection précoce, un traitement relai toutes les 2 à 3 semaines, suivant la dose de produit utilisée, sera nécessaire, jusqu’à la sortie de la dernière feuille, pour enrayer la progression de la maladie. Pour toutes les autres variétés, le premier traitement ne doit pas être envisagé avant le stade 2e nœud (32 BBCH).
La plupart des triazoles (epoxiconazole, tebuconazole, prothioconazole, cyproconazole) utilisées à dose correcte[7] sont efficaces contre la rouille jaune. L’association d’une strobilurine à une triazole permet d’accroître l’efficacité mais aussi la rémanence du traitement. Les produits à base de SDHI sont à conserver pour les traitements effectués sur la dernière feuille afin de profiter de leur très bonne efficacité contre la septoriose. L’alternance les substances actives utilisées à chaque traitement est primordiale. Ainsi, la triazole utilisée dans un traitement précoce contre la rouille jaune ne devra idéalement plus être pulvérisée sur la culture en cours de saison.
[1] Basidiomycètes : embranchement de champignons dont les spores sont formées à l’extrémité de cellules spécialisées, les « basides ». L’embranchement des ascomycètes regroupe des champignons dont les spores se forment dans des « asques ».
[2] Biotrophe : champignon phytopathogène colonisant les tissus vivants.
[3] Hétéroïque : se dit des parasites animaux ou végétaux qui ne peuvent accomplir leur cycle reproductif complet qu'en vivant sur plusieurs hôtes successifs (Synonyme : polyxène).
[4] Certaines sources inversent les définitions d’hôtes « primaires » et « secondaires », et définissent l’hôte primaire comme celui sur lequel s’effectue la reproduction sexuée.
[5] Mating-type : chez les champignons, les structures reproductrices ne sont pas différenciables morphologiquement (isogamie), les mots « mâle » et « femelle » ne peuvent donc pas être utilisés. C’est pourquoi, le terme de « mating-type » est employé pour désigner les mécanismes moléculaires régissant la compatibilité entre les cellules reproductrices. Dans le cas de la rouille jaune, les mating-type sont désignés par les symboles « + » et «-» et seul deux mating-type opposés peuvent se recombiner en une nouvelle structure. .
[6] http://eurowheat.au.dk/pathogens/stripe-rust/
[7] L’utilisation de produits à dose réduite diminue leur efficacité et leur durée d’action.